61. 반도체에서 Si의 건식식각에 사용하는 기체가 아닌 것은?
① CF4
② HBr
③ C6H6
④ CClF
해설
5) 식각공정(ething : 에칭)
~ 포토공정 후 필요한 회로 패턴을 제외한 나머지부분을 제거하는 공정 → 반도체의 필요한 회로를 만든다는 의미
식각의 분류
- 습식식각 : 침지, 스프레이
- 건식식각의 종류 : 플라스마, 이온빔, 반응성 이온 식각
플라스마 식각 : 대표적인 화학물질을 사용하는 공정
- 반응실은 CF4와 같은 특수 식각기체로 채우고 이때 적은 양의 산소를 첨가한다. 식각은 RF에너지를 기체혼합물에 가하여 플라스마를 발생시킴으로써 시작되는데 이렇게 식각이 이루어지는 이유는 반응성이 강한 불소나 불소화합물 등의 라디칼이 플라스마로부터 형성되기 때문이다.
일반적으로 박막의 종류에 따른 반응성 가스 및 배출물질이 존재하나, 식각에 관련한 반응식은 식각되는 실리콘 화합물에 관계없이 유사한데 일반적인 식각기체인 CF4 나 CHIF3 등과 같이 탄화수소와 수소가 포함되어 있다.
답: 3
62. 암모니아와 산소를 이용하여 질산을 합성할 때, 생성되는 질산 용액의 농도(wt%)는?
① 68
② 78
③ 88
④ 98
답2
63. 석유 정제공정에서 사용되는 증류법 중 중질류의 비점이 강하되어 가장 낮은 온도에서 고비점 유분을 유출시키는 증류법은?
① 가압증류법
② 상압증류
③ 공비증류법
④ 수증기증류법
1) 석유정제의 개요 : 원유의 주성분인 탄화수소의 혼합물들을 비등점 차이에 따라 분류하여, 연료유, 나프타, 윤활유 등의 각종 석유제품과 반제품을 제조하는 것이다.
2) 석유의 정제공정 : 물리적, 화학적 공정으로 크게 나눈다.
물리적 공정 : 증류, 추출, 흡착
화학적 공정 : 분해, 개질 등의 전화반응
- 증류공정 : 상압증류, 감압증류, 공비증류, 추출증류, 수증기 증류
3) 수증기 증류의 목적 :
- 증기압이 낮은 물질(비점이 높은 물질)을 비휘발성 물질로부터 분리
- 고온에서 분해하는 물질
- 물과 섞이지 않는 물질
감압증류
~ 상압증류의 잔유로부터 윤활유와 같은 고비점 유분이나 열분해용 유분을 얻기 위하여 사용된다. 상압증류로 사용할수 없는 고비점 잔유(350도 이상)는 그대로 온도를 올리면 열분해를 일으켜 품질이 나빠지고, 수율이 낮아지기 때문에 30~80 mmHg 정도로 감압하여, 유분의 끊는점을 낮춰서 증류하는 것이다.
답 : 4
64. 염화수소 가스의 직접 합성시 화학반응식이 다음과 같을 때 표준상태 기준으로 200L 의 수소가스를 연소시킬 때 발생되는 열량(Kcal)은? (반응식)

① 365
② 394
③ 407
④ 603
풀이)
H2 : Q = 22.4 L : 44.12
200 L : X
비례식을 풀면, X = 44.12 * 200 / 22.4 = 393.9 Kcal
답 2
65. 부식반응에 대한 구동력(Electromotive Force) E는?
(단, △G 는 깁스자유에너지, n는 금속 1몰당 전자의 몰수, F는 패러데이 상수이다)
① E = -nF
② E = -nF/
③ E = -nF△G
④ E = -△G/nF
해설)
■전지전위와 전지반응에서의 자유에너지변화
전자 n mole 의 전하량 : nF
음전하를 띤 전자를 양극으로부터 음극으로 잡아당기는 추진력 : E
J = nFE → △G (최대 비팽창의 일) = -nFE
계가 일을 했으므로, 부호는 ( - ) 이다.
△G = -nFE
답4
66. 인산 제조법 중 건식법에 대한 설명으로 틀린 것은?
① 전기로법과 용광로법이 있다.
② 철과 알루미늄 함량이 많은 저품위의 광석도 사용할 수 있다.
③ 인의 기화와 산화를 별도로 진행시킬수 있다.
④ 철, 알루미늄, 칼슘의 일부가 인산 중에 함유되어 있어 순도가 낮다.
해설)
3. 인산의 제조공정
인산의 공업적 제조방법(제법)에는 인광석( )을 원료로 하여 처리방법에 따라 습식과 건식이 있다.
1) 건식인산
~ 인광석을 환원하여 원소 인을 만들고, 이 인을 공기로 산화시켜 로 만든 후, 물에 흡수시켜 인산을 만드는 방법
① 전기로법
② 용광로법
건식인산의 제조

1단법의 특징 :
- 환원되기 어려운 물질을 slag에 포함시키고, 고순도 규사 사용으로 불순물의 혼입을 방지한다.
- 코크스는 휘발분과 회분이 적은 것이 좋으며, 인광석은 입도가 균일할 것
- 인 증기를 제진한후, 응축수(55~60℃)를 사용하여 냉각 응축시켜 액체인(황인)으로 만든다.
- 인의 기화 와 인의 산화, 수화가 일어난다.
- 용광로(전기로)에서 나오는 약간의 인산 미스트가 나오므로 포집기로 회수하여야 한다.
2단법의 특징 ( 현재는 2단법만 적용)
~ 응축기를 사용하지 않고, 인 증기 및 일산화탄소 혼합가스를 직접공기로 산화시키는 방법
- 건설비가 싸다
- CO의 이용
- 제품의 순도가 높다
- 전기로에서 나오는 CO가스로 수소의 제조와 연료로 이용
답4
67. Friedel-Crafts 반응에 사용하지 않은 것은?

■벤젠의 친전자성 방향족 치환반응
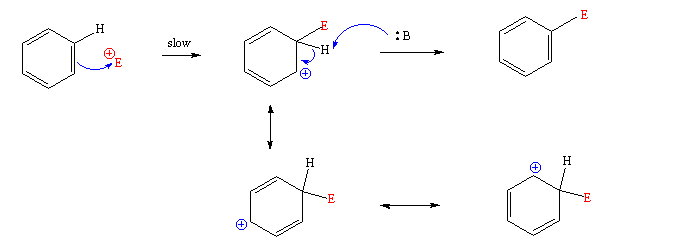
1) 벤젠의 활로겐화반응
2) 벤젠의 니트로화반응
3) 벤젠의 술폰화반응
4) 벤젠의 Friedel- Crafts 알킬화반응 ( 벤젠 + 알킬기) = 벤질 그룹
5) 벤젠의 Friedel- Crafts 아실화반응 ( 벤젠 + 아실기)
친전자체 ( E+)
①아실(acyl)기 group : = 아세틸기

②알킬기 group :

풀이)
② 카르복시실산 무수물은 친전자체(아실기)이다
③ 은 카르보양이온 형태로 친전자체(알킬기)이다.
④ 은 카르보양이온 형태로 친전자체(알킬기)이다.
답1
68. 전화공정 중 아래의 설명에 부합하는 것은?
| - 수소화/ 탈수소화 및 탄소양이온 형상촉진의 이원기능 촉매사용 - Platforming, Ultraforming 등의 공정이 있음 - 생성물을 가솔린으로 사용시, 벤젠의 분리가 반드시 필요함 |
① 열분해법
② 이성화법
③ 접촉분해법
④ 수소화분해법
전화공정 : 부가가치가 적은 석유 유분을 여러방법으로 화학변화시켜 전보다 우수한 새로운 석유제품으로 바꾸는 공정
1) 열분해법(Thermal cracking, pyrolysis) 비스브레이킹법, 코킹법, 수증기열분해법
2) 접촉분해법(Catalytic craking process) :
~ 끊는점이 높은 큰 분자의 탄화수소를 분해하는 방법으로 촉매를 사용하여 분해시키는 공정이며, 특히 중질유를 촉매 존재하에 고온에서 분해하여 고옥탄가의 가솔린 제조하는 방법
(1) 접촉분해의 원료 : 경유~ 상압증류의 잔유까지 사용
(2) 접촉분해의 촉매 : 제올라이트 ← 제올라이트 성질 : ① 이온 교환능, ② 분자체작용, ③형상선택성 촉매작용
(3) 접촉분해의 공정의 종류
3) 접촉개질법
4) 수소화분해법
5) 이성질화법
6) 알킬화법
7) 중화법
8) 수증기 개질법
답3
69. 양이온 중합에서 공개시제(Co-initiator)로 사용되는 것은?
① Lewis 산
② Lewis 염기
③ 유기금속염기
④ Sodium amide
답1
70. 모노글리세라이드에 대한 설명으로 가장 옳은 것은?
① 양쪽성 계면활성제이다.
② 비이온 계면활성제이다.
③ 양이온 계면활성제이다.
④ 음이온 계면활성제이다.
계면활성제 :
한분자내에 친수성기 와 친유성기를 함께 가지고 있는 분자로서, 친수성기는 머리 부분, 친유성기는 꼬리부분모양을 나타낸다. 친수성기의 이온상태에 따라 물질의 구분이 달라진다.
또한, 상간의 경계면 활성화를 통한 표면장력의 강하력으로 인해, 표면의 습윤, 침투, 기포, 소포, 유화, 가용화, 분산, 응집 및 세정 등의 작용을 가져, 모든 세제와 화장품 및 최근 전 산업에 필수적으로 사용되는 주원료이다.
계면활성제의 종류
1) 이온성 계면활성제 :
①음이온 계면활성제 : 용해 시, 친수기의 상태는 음이온이 된다 : 기포성, 세정력 우수 → 비누, 삼푸
②양이온 계면활성제 : 용해 시, 친수기의 상태는 양이온이 된다. : 살균성, 섬유흡착력 우수 → 섬유유연제
③양성 계면활성제 : 용해 시, 친수기의 상태는 음,양이온을 가지고 있다. : 경수연화제, 살균력 → 주방세제
2) 비이온성 계면활성제 : 용해 시, 친수기의 상태는 이온을 가지고 있지 않다. : 뛰어난 유화력 우수, 피부에 안전 → 식품, 의약품 → 에스테르 형, 에테르 형, 에스테르*에테르형, 그 외

R1(포화탄화수소: 알킬기) R2와 R3 (OH기) → 모노글리세리드
R1,R2(포화탄화수소: 알킬기 ) R3 (OH기) 디글리세리드
R1,R2,R3(포화탄화수소: 알킬기) - 트리글리세리드
3) 천연 계면활성제(식물성) : 주로 콩이나 계란 등에 들어있는 레시틴, 인삼에 들어있는 사포닌이다.
4) 고분자 계면활성제
5) 실리콘 계면활성제
‣세정효과 : 음이온 > 양쪽성> 양이온 > 비이온성
‣피부자극정도 : 양이온> 음이온 > 양쪽성 > 비이온성
답2
71. Le blanc법 소다회 제조공정이 오늘날 전적으로 폐기된 이유로 옳은 것은?
① 수동적인 공정(bath process)
② 원료인 Na2SO4의 공급난
③ 고순도 석탄의 수요증가
④ NaS 등 부산물의 수요감소
1. 탄산소다의 개요
~ 산업혁명이후, 화학 산업에서 소다회 수요가 급격히 증가하게 되었으며(표백에 의한 천연소다 공급 부족현상), 전근대적인 소다회 제조방법으로 수요를 충족할 수 없게 되었다.
(화학적인 소다생산의 필요성 대두) :
르블랑법 → 암모니아소다법(솔베이법) → 염안소다법
2. 성질과 용도
① 백색분말 또는 입상형태
② 흡습성이 강하며, 비교적 약알카리성
③ 저장이나 수송이 쉽다
④ 값싸며, 대량생산이 가능하여, 기초원료로 사용
3. 제조공정
1) 르블랑법
~ 다음과 같이 두 단계로 진행되는데 1단계에서는 소금과 진한황산을 주철제 용기 내에서 200℃내에서 반응시키면 고체 NaHSO4만을 얻을 수 있다.

2) 특징
① 식염(NaCl)을 원료
② 망초(황산소다, Na2SO4) 생성
③ 부생염산이 생산
3) 문제점
- 염산의 발생 및 처리곤란
- 알카리폐액 발생 ( CaO, CaO3 ....)
- 고동력, 제품 품질 문제( Na2CO3 : 45%로 저조 )
답1
72. 다음 중 설폰화 반응이 가장 일어나기 쉬운 화합물은?

■벤젠의 친전자성 방향족 치환반응
치환된 벤젠고리 (치환기를 가지는 벤젠 , 알킬벤젠) 의 반응성 = 친전자성 방향족 치환반응의 예
즉, 1치환된 벤젠 + 술폰화반응 → 2치환된 벤젠
1치환된 치환기의 종류에 따라 반응성(반응의 속도) 과 배향성(ortho , para) 영향을 준다. (2치환된 벤젠의 배향성)
치환기는 전자를 주는기와 전자를 당기는기 로 나뉜다.
전자 주는기는 벤젠고리의 활성을 증가시켜 친전자성 방향족 치환반응의 반응속도를 높이게 된다.
전자를 주는 치환기의 활성 크기순서 : -NH2 > -NR3 > - OH > -OR > -X
답3
73. 다음 중 칼륨비료의 원료가 아닌 것은?
① 칼륨광물
② 초목재
③ 간수
④ 골분
3) 칼륨질비료
~ 칼륨은 식물의 세포에 존재하여, 그 존재량에 따라 삼투압으로 세포 중의 수분을 조절하고, 광합성과 탄수화물의 축적, 단백질의 합성에 관여하는 중요한 원소이다.
~ 식물의 재에는 다량의 칼륨이 포함되어 있기 때문에, 예로부터 목초의 재가 칼륨비료로서 사용되어 왔다.
염화칼륨
- Silvinite(KCl+NaCl) 나 Carnallite 광물로부터 얻는다.
- Silvinite의 제조
황산칼륨
- 시에나이트
답4
74. 소금물의 전기분해에 의한 가성소다 제조공정 중 격막식 전해조의 전력원단위를 향상시키기 위한 조치로서 옳지 않은 것은?
① 공급하는 소금물을 양극액 온도와 같게 예열하여 공급한다.
② 동판 등 전해조 자체의 재료의 저항을 감소시킨다.
③ 전해조를 보온한다.
④ 공급하는 소금물의 망초( )함량을 2%이상 유지한다.
2) 식염의 전해소다법(수은법, 격막법, 이온교환법(멤브레인))
1. 개요
~ 전기분해는 전기에너지를 이용하여 산화와 환원반응에 의하여 화학에너지로 전환되는 공정이며, 전지나 연료전지는 화학에너지가 전지에너지로 전환되는 공정이다. 이러한 과정에 고려해야 할 사항은 매우 다양하다.
즉, 전기화학 시스템을 구성할 때 가장 기본이 되는 두 종류의 전극, 전해질, 격막 등은 가장 먼저 고려할 사항이다. 전기분해의 경우, 생성물은 적합한 화합물이나 원소로 이루어진다.
이러한 반응의 발생을 제어하고, 전해반응기의 설계에 관계되는 조작이 전기화학 공학자의 역할이다.
용매, 지지전해질(active material), 물질의 농도, 전해질의 유동상태, 기하학적 모양과 재료, 반응기의 전위, 전류, 온도 등을 조절하여야 한다.
공업적으로 요구되는 반응의 반응속도를 증가시키고, 부 반응의 반응속도를 감소시키며, 여러 반응기의 연속공정을 선택하는 것이 주어진 공간과 시간에서 최대한 수율을 올리는 것이다.
풀이)
E(전압) = E(환원) - E(산화) - 전해조의 저항 - 과전압
① (이동분해)전압 = 표준환원전위 - 표준산화전위 이고, 온도가 상승에 따라 이동분해전압이 낮아진다.
② 전해조의 저항을 최소로 하여, 전압 효율을 높혀야 한다.
③ 저항을 최소로 하기 위해 전해조의 온도를 유지할 필요가 있다.
④ 원염을 정제하여 고농도 간수를 만들어야 한다. 망초함량을 줄일 필요가 있다.
답4
75. 암모니아 합성방법과 사용되는 압력(atm)을 짝지어 놓은 것 중 옳은 것은?
① Casale법 - 약 300atm
② Fauser법 - 약 600atm
③ Claude법 - 약 1000atm
④ Haber - Bosch법 - 약 500atm
암모니아공업
1. 개요
암모니아는 단백질의 구성 성분으로 요소비료, 화약, 염료, 의약품 등의 출발원료이며, 중요한 무기물질의 하나이다. 암모니아가 질소와 수소의 화합물이라는 점은 18세기에 밝혀졌으며, 1885년에 촉매 존재하에서 암모니아의 생성분해반응이 가역반응임을 발견하고, 질소와수소로부터 직접 합성이 가능하다는 것을 시사하였다.
그러나, 공기의 80%를 차지하는 질소분자의 결합에너지가 160 kca/mol 로 크기 때문에, 질소고정에는 커다란 에너지가 요구된다.
2. 암모니아의 성질
- 가벼운 무색의 기체
- 자극적인 강한 냄새
3. 원료가스 수소의 제조
~원료가스는 질소와 수소(1:3몰비)로 이루어지며, 질소는 수소제조 공정 중에 도입되는 경우가 많다.
순수한 질소의 형태로 첨가되는 경우라 할지라도 공기의 액화분리에 의해 쉽게 얻어지므로, 경제적으로 부담이 되지 않는다. 따라서 원료가스의 비용을 줄이는데의 역할은 수소를 경제적으로 만들까하는데 달려있다.
4. 원료가스 질소의 제조
~ 암모니아 합성용 원료가스 중 질소는 수증기 개질법의 경우에는 2차개질공정에서 공기에 의한 부분 연소반응 과정에서 공급된다.
그러나, 부분산화법의 개질공정에서는 순수한 산소를 이용하여 반응을 행하므로, 생성 수소에 질소를 따로 넣어 수소 : 질소 몰비가 3:1인 합성용 원료가스를 만든다.
5. 암모니아 합성
~ 암모니아 합성용 원료 가스 질소와 수소를 1:3의 몰비로 합성탑으로 보내 제조한다. 암모니아 합성은 미반응 가스의 순환방식을 택하고 있어 질소와 수소가 과잉으로 존재하면 순환 중에 축적되어 합성반응을 저해하게 되므로, 원료 가스의 조성이 대단히 중요하다.
1) 합성탑
~ 고온 고압하에서 이루어지거나, 촉매를 사용하는 반응이므로 촉매에 가장 적합한 온도를 설정하는것도 중요하다.
2) 합성조건에 따른 제조공정법 (압력, 온도, 농도, 주촉매, 조촉매)
|
방법 |
압력(atm) |
온도 |
(%) |
주촉매 |
조촉매 |
|
하버-보쉬법 |
300 |
500~600 |
8~12 |
|
|
|
카샬법 |
500~700 |
450~500 |
18~20 |
|
|
|
파우져법 |
200~300 |
450~500 |
12~15 |
|
|
|
클라우드법 |
900~1000 |
500~650 |
24~29 |
|
|
답3
76. 니트로벤젠을 환원시켜 아닐린을 얻을 때 다음 중 가장 적합한 환원제는?
① Zn + Water
② Zn + Acid
③ Alkaline Sulfide
④ Zn + Alkali
촉매
금속 or 금속 + 고체산 : 수소화 촉매
금속 중 d전자 전이금속은 각 분자에 대해 흡착 능력을 달리 한다. 예를 들어 H2,O2,N2,NO 등 2원자 분자를 분자상으로는 흡착하지 않고, 절단하여 해리흡착하는 금속이 있으며, 금속에 따라 그 흡착 강도가 변환다.

답2
77. 다음 원유 및 석유 성분 중 질소 화합물에 해당하는 것은?
① 나프텐산
② 피리딘
③ 나프토티오펜
④ 벤조티오펜
질소화합물은 원유 중에 소량 존재하며, 저비점 석유유분 중에는 거의 존재하지 않으며, 고비점 석유유분 중에는 소량 존재한다.
원유 중에 유기질소 화합물은 피리딘, 퀴놀린, 피롤의 헤테로 고리 형태로 혹은 복잡한 구조로 존재한다.
대부분의 원유에 들어 있는 질소함량은 0.1wt% 정도이나 몇가지 중질 석유유분 중에는 0.7%~0.9 인경우도 잇다.
답2
78. 디메틸테레프탈레이트와 에틸렌글리콜을 축중합하여 얻어지는 것은?
① 아크릴 섬유
② 폴리아미드 섬유
③ 폴리에스테르 섬유
④ 폴리비닐알코올 섬유
폴리에스테르(폴리에스터) 섬유 : 가장 광범위하게 사용하는 합성섬유
에스테르화반응(Esterification) : 카르복실산 + 알코올 → 에스테르 + 물
테레프탈산 + 에틸렌글리콜 → 폴리에스테르 + 물


폴리에스테르= 폴리에스터 = 폴리에틸렌테레프탈레이트 = PET
답3
79. 접촉식 황산 제조 공정에서 이산화황이 산화되어 삼산화황으로 전환하여 평형상태에 도달한다. 삼산화황 1 kmol을 생산하기 위해 공기의 최소량(Sm3)은?
① 53.3
② 40.8
③ 22.4
④ 11.2
답1
100. 정상상태의 라디칼 중합에서 모노머가 2000개 소모되었다. 이 반응은 2개의 라디칼에 의하여 개시, 성장 되었고, 재결합에 의하여 정지반응이 이루어 졌을 때, 생성된 고분자의 동역학적 사슬길이 ⓐ와 중합도ⓑ 는?
① ⓐ : 1000 , ⓑ : 1000
② ⓐ : 1000 , ⓑ : 2000
③ ⓐ : 1000 , ⓑ : 4000
④ ⓐ : 2000 , ⓑ : 4000
해설
동역학적 사슬 길이 v
v는 개시반응에서 생성된 라디칼이 반응정지까지 소비한 단량체의 평균수를 말하며 다음 식으로 표시된다.
즉, 개시제에 의해 하나의 라디칼단량체가 생장을 정지할 때까지의 반응하는 단위체 분자의 총수를 말한다.
따라서, 이 값은 중합반응속도와 활성화 반응속도의 비로 주어지며, 반응사이에 몇 번 연쇄이동이 반복되어도 무관하다.
1. 라디칼중합의 정지 반응속도론의 중합도
~ 이론적으로는 연쇄반응은 모든 단량체가 소진될 때까지 진행 가능하지만, 라디칼의 불안전성과 상호결합으로 다음의 반응경로로 종결된다.
1) 결합반응~ 라디칼의 상호결합으로 하나의 고분자가 생성
2) 불균등반응~ 수소 재배열, 포화/불포화 말단기를 가진 두 개의 고분자 생성
① 결합반응으로 종결반응이 일어나는 경우의 중합도 Xn = 2v
② 불균등반응으로 종결반응이 일어나는 경우의 중합도 Xn = v
③ 결합반응과 불균등반응이 같이 일어나는 경우의 중합도
풀이)
정상상태의 라디칼중합반응 : 결합반응으로 라디칼의 상호결합이다
v = 2000/2 = 1000
Xn = 2v
Xn = 2000
답2
'● 화공기사 공업화학' 카테고리의 다른 글
| 2019년 화공기사 1회차 공업화학 기출풀이(수정중) (0) | 2021.03.06 |
|---|---|
| 2019년 화공기사 2회차 공업화학 기출풀이(수정중) (0) | 2021.03.06 |
| 2019년 화공기사 4회차 공업화학 기출풀이(수정중) (0) | 2021.03.06 |
| 2020년 화공기사 1~2회차 공업화학 기출풀이 (0) | 2021.03.04 |
| 2020년 화공기사 3회차 공업화학 기출풀이 (0) | 2021.03.04 |




댓글